ISO 14971:2019 醫療器材-醫療器材風險管理
說明醫療器材風險管理中使用的專業術語、原理及流程。 幫助醫療器材製造商識別醫療器材的可遇見危害(如生物相容性、電性、輻射…等等)。 建立風險可接受性的客觀標準,評估和估計這些風險,並確保風險管控措施的有效性。
ISO 14971:2019 醫療器材-醫療器材風險管理
風險評估報告改版最新消息
什麼是 ISO 14971:2019 醫療器材-醫療器材風險管理應用
ISO 14971 :2019 正式的官方名稱為 Medical devices — Application of risk management to medical devices(醫療器材-醫療器材風險管理應用),為 ISO 13485醫療器材品質管理系統之風險管理績效指引,主要目的可涵蓋:
- 說明醫療器材風險管理中使用的專業術語、原理及流程。
- 幫助醫療器材製造商識別醫療器材的可遇見危害(如生物相容性、電性、輻射…等等)。
- 建立風險可接受性的客觀標準,評估和估計這些風險,並確保風險管控措施的有效性。

ISO 14971 :2019風險管理簡介
ISO 14971 :2019要求製造商應在醫療器材整個生命週期內,建立風險管理流程識別與醫療器材有關的危害,針對這些危害估計和評估可能的風險,以及確保這些風險管控措施的有效性。
對於風險管理計劃 ISO 14971 :2019有以下要求:
- 風險管理活動的計劃範圍,識別和描述醫療器材及生命週期階段於計劃中適用的每個要素
- 職責和權限的分配
- 審查風險管理活動的要求
- 風險可接受性的標準,依據製造商確認可的接受風險政策,包含無法估計損害可能發生率的風險可接受標準
- 依據製造商認可的可接受風險政策,評估總殘餘風險的方法及總殘餘風險的可接受性標準
- 驗證風險控制措施實施與有效性的活動
- 收集和審查與生產/生產後資訊有關的相關活動
如果風險管理計劃在醫療器材的生命週期中發生變更,風險管理文件應留有變更的記錄。通過確認風險管理文件來查核是否符合要求。I
ISO 14971 :2019 醫療器材-醫療器材風險管理適合那些產業?
一般來說 ISO 14971 :2019的主要適合對象為與 ISO 13485 :2016有關之產業如:
- 醫療器材設計及製造商 (包含有安裝軟體的醫療器材與體外診斷醫療器材)
- 醫療器材設計開發商
- 涉及醫療器材生命週期中的其他使用產品
不適用範圍
- 用於判定醫療器材臨床試驗之風險
- 用於商業風險管理
為什麼 ISO 14971 :2019 醫療器材-醫療器材風險管理應用要改版?
ISO 14971的主要目的,是幫助醫療器材製造商識別危害並估計與醫療器材相關的風險,以確保風險能有效監控與實施,基於這個原則,ISO國際標準組織順應了當前的市場需求,新增或修改專有名詞的解釋,並調整了風險管理中的步驟或流程說明,以確保醫療器材製造商能夠更容易達到醫療器材產品的安全性。
ISO 14971 :2019 醫療器材-醫療器材風險管理的改版重點是什麼?
強化ISO/TR 24971在醫療器材風險管理計劃的重要性
原本 ISO 14971中用於風險評估分析的說明及指引的附錄,共有六個將移至 ISO/TR 24971中如下:
- 附錄C 用於識別可能影響安全性的醫療器材特徵的問題
- 附錄D 用於醫療器材的風險概念
- 附錄F 風險管理計劃
- 附錄G 風險管理技術資訊
- 附錄H 體外診斷醫療器材風險管理指南
- 附錄J 安全性資訊和殘餘風險資訊
這代表未來在執行醫療器材風險評估時,必須依照 ISO/TR 24971中的指引來完成醫療器材風險評估報告。
強化 ISO 14971 :2019風險管理的流程
新版強化了有關風險管理計劃(Risk Management Plan)的流程敘述及要求,雖然這些內容已存在於舊版的 ISO 14971,但在新版中,以更具體的要求或執行方向規範風險管理計劃,例如:
- 風管理計劃須包含總殘餘風險的評估方法及可接受標準
- 加強醫療器材預期用途的考量要求
- 定性/定量與醫療器材安全性有關之項目
- 強化危害/危害情境/可預見危害之範例說明
- 若無法估計危害情境發生損害的可能性,應列出可能後果以用於風險評估和風險控制
新增/修改術語定義
新版 ISO 14971 :2019 新增三個名詞 定義如下:
3.2受益(benefit)
醫療器材(3.10)在使用上對於個人健康具有利之影響,或有利病患管理及公共衛生。
註1:受益包含對臨床結果、病患的生活品質、診斷結果具有利影響,利於臨床診斷設備產出結果,或利於公共衛生。
3.15合理可預見的誤用(reasonably foreseeable misuse)
由可預測的人類行為導致產品或系統在使用上不符製造商的預期。
註1:可預測的人類行為涵蓋所有類型的行用者行為,如專業和非專業用戶。
註2:合理可預見的濫用可能是有意的或無意的。
3.28最新技術(state of the art)
綜合科學、科技與經驗相關發現的基礎上,於開發階段依照技術能力評估產品、流程(3.14)與服務。
註1:最新技術包含當前普遍認可在科技和醫學上之優良規範。最新技術不一定指最先進的技術解答。這裡所描述的最新技術有時被稱為 "普遍公認的最新技術"。
修改部分名詞 定義,以下列舉二例,如:
3.3損害(harm) ,移除「Physical」
Physical injury or damage to the health of people, or damage to property or the environment
新版定義:傷害或損壞人類健康、損害財產或環境
註解:新版定義將損害的範圍擴大,將不合理的心理壓力或意外情況作為損害人類健康的一部分(如醫療器材偽陽性診斷、避孕器材的意外懷孕)
3.6 預期用途 / 預期目的(intended use / intended purpose)增加註解
註解:典型的預期用途要素如:預期的醫學適應症、患者人數、與其做動的身體部位或組織類型、用戶資料、使用環境和操作原理
強化 ISO 14971 :2019與其他標準的關聯性
在新版的內容中,在部分的敘述上加強了與其他標準的關聯性,比如舊版的附錄I 生物危害的風險分析流程指引,在新版中刪除此附錄,要求大家需參考 ISO 10993-1執行。
其他與醫療器材風險評估較有關聯之標準:
- ISO 10993-1,醫療器材的生物學評估-第1部分:風險管理過程中的評估和測
- ISO 14155,醫療器材人體臨床試驗 – 優良臨床試驗規範
- ISO 20916,體外診斷醫療器材 – 使用人體樣本進行臨床性能研究 – 優良研究規範
- ISO / TR 24971,醫療器材-ISO 14971應用指引
- IEC 60601-1,醫療電氣設備-第1部分:基本安全性和基本性能的一般要求
- IEC 62366-1 :2015,醫療設備—第1部分:可用性工程在醫療器材中的應用
強化 ISO 14971 :2019與其他標準的關聯性
新版 ISO 14971 :2019增加與國際法規之調和性
新版 ISO 14971將與歐盟醫療器材法規(MDR/IVDR等)調和,以消彌舊版與法規差異性的情形,如此一來也能降低企業符合性方面的困擾。
比如在新版中,第10章生產和生產後資訊,加入了有關資訊蒐集與審查的項目,要求醫療器材商需要滿足以下內容:
新版 ISO 14971 :2019資訊收集要求:
(1) 生產過程及生產流程監控產出的資訊
(2) 使用者產出的資訊
(3) 由負責醫療器材安裝、使用、維護人員產出的資訊
(4) 供應鏈產出的資訊
(5) 公開可用的資訊
(6) 相關的一般資訊
新版 ISO 14971 :2019資訊審查重點:
(1) 出現先前未識別出的危害或危害情境
(2) 危害情境的風險估計結果為不可接受
(3) 總殘餘風險中預期用途的有關受益為不可接受
(4) 普遍公認的最新技術已改變
ISO / TR 24971與 ISO 14971 :2019的關係
ISO / TR 24971正式的官方名稱為 MEDICAL DEVICES — GUIDANCE ON THE APPLICATION OF ISO 14971(醫療器材-ISO 14971應用指引),繼 2019 年底 ISO 14971 的改版,ISO / TR 24971 也隨著在 2020 年正式改版了。
ISO / TR 24971的主要目的,是指引醫療器材製造商和用戶,如何將產品安全和流程標準在風險管理中實現,制定可接受風險管理政策,將生產和生產後資訊作為循環納入風險管理範圍內,以及區分“安全信息”和“揭露殘餘風險”,評估總殘餘風險。
基本上 ,ISO / TR 24971 修訂完後的章節與 ISO 14971的架構大抵一致,但部分會有更多解釋,附錄如下:
- 附錄A / 危害和安全特徵的識別(Identification of hazards and characteristics of safety)
- 附錄B / 風險分析技術(Techniques that support risk analysis)
- 附錄C / 政策、風險可接受性準則、風險管制、風險評估之間的關係(Relation between the policy, criteria for risk acceptability, risk control and risk evaluation)
- 附錄D / 安全資訊和殘餘風險資訊(Information for safety and information on residual risk)
- 附錄E / 國際標准在風險管理中的用途( Role of international standards in risk management )
- 附錄F / 與安全相關的風險指引(Guidance on risks related to security)
- 附錄G / 未使用 ISO 14971 設計的零件和器材(Components and devices designed without using ISO 14971)
- 附錄H / 體外診斷醫療器材指引(Guidance for in vitro diagnostic medical devices)
ISO 14971 :2019的基本要求
ISO 14971 要求在醫療器材設計研發階段,每類產品應至少產出一份風險評估報告,以協助醫療器材製造商在研發階段了解醫療器材可能遭遇之風險,避免使用醫療器材之患者或人員發生損害(harm)。
因此,醫療器材風險評估報告不可一成不變,至少應在以下時機回顧醫療器材風險評估報告的適切性:
(1)每年例行定期進行一次風險管理計畫回顧。
(2)遇到重大客戶投訴或批量不合格時
(3)設計變更
(4)製程變更
(5)原材料或供應商的變更
(6)發生條文10.3之情形
新版 ISO 14971 :2019執行重點
此次 ISO14971 :2019的改版,醫療器材風險評估報告應考量流程如下:
(1)回顧及審查現有風險管理計畫是否滿足新版條文要求
(2)檢視風險評估之手法,是否依照 ISO / TR 24971之內容執行
(3)依照 ISO / TR 24971執行風險評估(因新版ISO / TR 24971尚未發行,故先依舊版之附錄執行)
(4)調整風險評估報告之內容
(5)產出新版風險評估報告(需符合 ISO 14971 :2019 及 ISO / TR 24971)
(6)依條文要求定期執行風險管理審查以確保風險管理計劃的適切性,審查內容至少包含:
Ⅰ. 風險管理計劃已適當地實施;
Ⅱ. 總殘餘風險的評估方式是可接受的;
Ⅲ. 以適當方法蒐集與審查生產和生產後資訊。
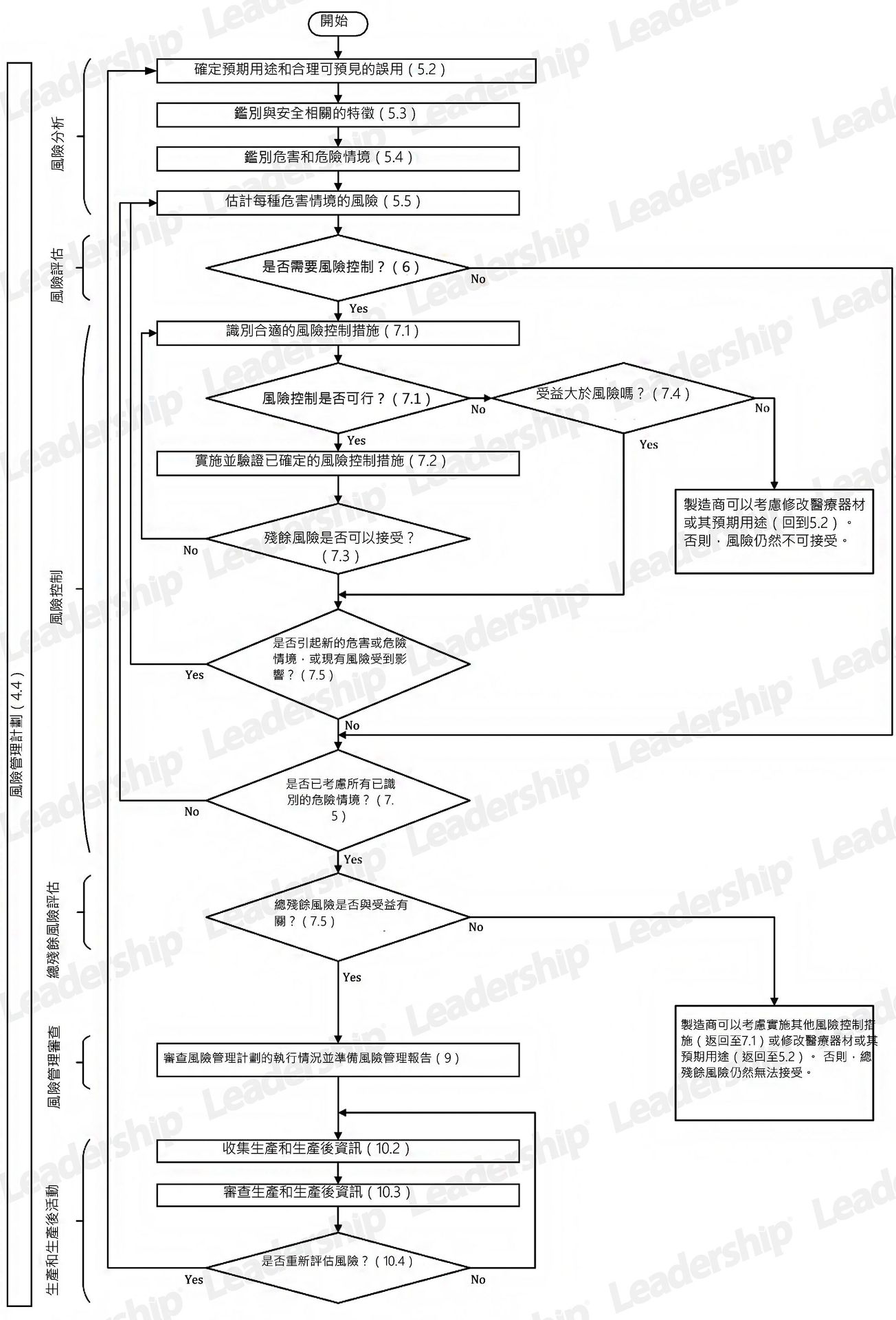
ISO 14971 :2019 醫療器材風險管理計劃流程圖
ISO 14971新舊版條文對照表
| ISO 14971: 2007 |
ISO 14971:2019 |
| 前言 | 前言 |
| 1 範圍 | 1 範圍 |
| (新條款) | 2 參考文件 |
| 2 專有名詞與定義 | 3 專有名詞與定義 |
| 3 風險管理系統的一般要求 | 4 風險管理系統的一般要求 |
| 3.1 風險管理流程 | 4.1 風險管理流程 |
| 4.2 管理職責 | |
| 3.3 人員能力 | 4.3 人員能力 |
| 3.4 風險管理計劃 | 4.4 風險管理計劃 |
| 3.5 風險管理文件 | 4.5 風險管理文件 |
| 4 風險分析 | 5 風險分析 |
| 4.1 風險分析流程 | 5.1 風險分析流程 |
| 4.2 與醫療器材安全性有關的預期用途和特徵識別 | 5.2 預期用途和合理可預見的誤用 |
| 5.3 識別與安全相關的特徵 | |
| 4.3 識別危害 | 5.4 識別危害和危害情境 |
| 4.4 估計每種危害情境下的風險 | 5.5 風險估計 |
| 5 風險評估 | 6 風險評估 |
| 6 風險控制 | 7 風險控制 |
| 6.1 降低風險 | (刪除子條款) |
| 6.2 風險控制方案分析 | 7.1 風險控制方案分析 |
| 6.3 實施風險控制措施 | 7.2 實施風險控制措施 |
| 6.4 殘留風險評估 | 7.3 殘餘風險評估 |
| 6.5 受益-風險分析 | 7.3 殘餘風險評估 |
| 6.6 風險控制措施引起的風險 | 7.5 風險控制措施引起的風險 |
| 6.7 風險控制的完整性 | 7.6 風險控制的完整性 |
| 7 總殘餘風險可接受性評估 | 8 總殘餘風險的評估 |
| 8 風險管理報告 | 9 風險管理審查 |
| 9 生產和生產後資訊 | 10 生產和生產後活動 |
| 10.1 一般要求 | |
| 10.2 資訊收集 | |
| 10.3 資訊審查 | |
| 10.4 行動 | |
| 附錄A要求的理由 | 附錄A(資料性)要求的理由 |
| 附錄B醫療器材風險管理流程概述 | 附錄B(資料性)醫療器材風險管理流程 |
| 附錄C用於識別可能影響安全性的醫療器材特徵的問題 | 移至ISO / TR 24971 |
| 附錄D用於醫療器材的風險概念 | 移至ISO / TR 24971 |
| 附錄E危害、事件或危害情境的可預見後果舉例 | 附錄C(資料性)風險基本概念 |
| 附錄F風險管理計劃 | 移至ISO / TR 24971 |
| 附錄G風險管理技術資訊 | 移至ISO / TR 24971 |
| 附錄G風險管理技術資訊 | 移至ISO / TR 24971 |
| 附錄I 生物危害的風險分析流程指南 | (附件已刪除) |
| 附錄J安全資訊和殘留風險資訊 | 移至ISO / TR 24971 |
| 參考文獻 | 參考文獻 |
ISO 14971 :2019 轉版課程大綱
課程大綱
ISO 14971:2019 改版重點說明
(1) 定義更動:名詞解釋說明
(2) 改版項目說明:新舊版比較介紹
ISO 14971:2019標準簡介
(1) 醫療器材風險管理說明:從流程圖理解建立原則&執行步驟
(2) ISO 14971:2019條文重點解析
(3) 改版後執行重點說明:改版執行差異分析
醫療器材風險管理原則及實務重點
(1) 風險評估報告需求及重點說明
(2) 重點解析一:識別可能影響安全性的醫療器材特徵的問題(ISO 14971:2007附錄C,附錄F)
(3) 重點解析二:危害、事件或危害情境的可預見後果(ISO 14971:2007附錄E)
(4) 重點解析三:PFMEA執行重點
改版後執行注意事項彙整
(1) 風險評估報告後續執行措施
測驗
(1) 醫療器材風險評估報告內部人員教育訓練測驗
★ 課程成果 ★
測驗合格可取得 Leadership 醫療器材風險管理證書
課程大綱
ISO 14971:2019改版重點說明
(1) 定義更動:名詞解釋說明
(2) 改版項目說明:新舊版比較介紹
ISO 14971:2019 標準簡介
(1) 醫療器材風險管理說明:從流程圖理解建立原則&執行步驟
(2) ISO 14971:2019條文重點解析
(3) 改版後執行重點說明:改版執行差異分析
實務討論:新版ISO 14971:2019 風險評估報告模版
(1) 醫療器材風險管理原則及實務重點
(2) 產出文件:識別可能影響安全性的醫療器材特徵的問題(ISO 14971:2007附錄C,附錄F)
(3) 產出文件:危害、事件或危害情境的可預見後果(ISO 14971:2007附錄E)
(4) 產出文件:PFMEA風險評估表
改版後執行注意事項彙整
(1) 風險評估報告後續執行措施
測驗
(1) 醫療器材風險評估報告內部人員教育訓練測驗
★ 課程結果 ★
測驗合格可取得 Leadership 醫療器材風險管理證書
ISO 14971:2019新版風險評估報告模板
課程大綱
ISO 14971:2019改版重點說明
(1) 定義更動:名詞解釋說明
(2) 改版項目說明:新舊版比較介紹
ISO 14971:2019 標準簡介
(1) 醫療器材風險管理說明:從流程圖理解建立原則&執行步驟
(2) ISO 14971:2019條文重點解析
(3) 改版後執行重點說明:改版執行差異分析
實作討論:依企業現有風險評估報告修改討論產出新版 ISO 14971:2019風險評估報告模板
(1) 醫療器材風險管理原則及實務重點
(2) 產出文件:識別可能影響安全性的醫療器材特徵的問題(ISO 14971:2007附錄C,附錄F)
(3) 產出文件:危害、事件或危害情境的可預見後果
(ISO 14971:2007附錄E)(4) 產出文件:PFMEA風險評估表
(5) 依客戶實際產品需求強化相關風險考量需求,如:與安全防護(security)相關的風險指引
改版後執行注意事項彙整
(1) 風險評估報告後續執行措施
測驗
(1) 醫療器材風險評估報告內部人員教育訓練測驗
★ 課程結果 ★
測驗合格可取得 Leadership醫療器材風險管理證書。
依實際案例討論需求,產出至少 1 份企業專屬 ISO 14971:2019新版風險評估報告模板。
以實務角度而言,委託領導力企管培訓 ISO 14971,最終可以獲得哪些成果?
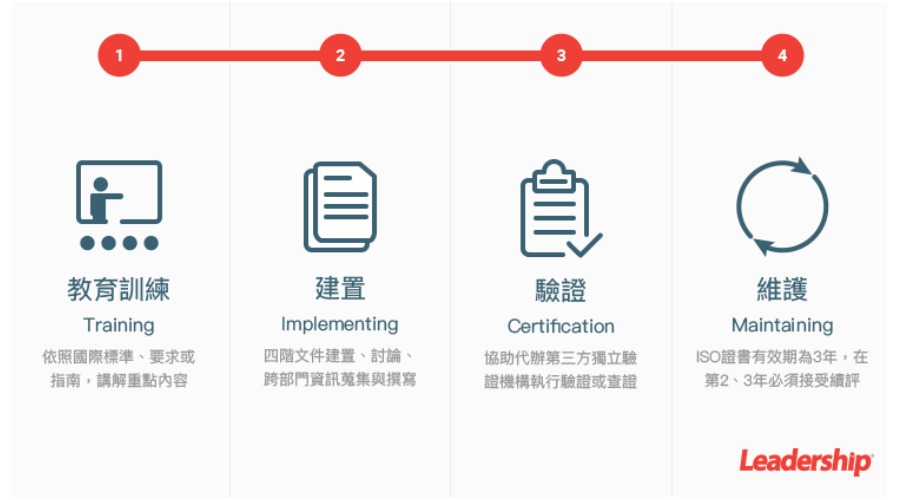
領導力企管提供ISO認證或各式國際標準最佳解決方案,包括第1:提供教育訓練(Training)、第2:建置(Implementing)、 第3:驗證(Certification)、第4:維護(Maintaining)共計4大服務項目。協助有效率的建立各式國際標準系統,例如 ISO 14971 。最終產出符合規定的程序書、紀錄等相關文件,順利通過第三方驗證機構認證,取得符合國際公信力的國際標準證書。
