ISO 13485:2016 醫療器材品質管理系統標準
ISO 13485 包含了一些醫療器材的專業要求,刪減了 ISO 9001不適於作爲法規要求的某些要求,例如 客戶滿意度專章要求。
ISO 13485:2016 醫療器材品質管理系統標準
ISO 13485:2016 Medical Devices - Quality Management Systems
什麼是 ISO 13485 :2016?讓您的醫療器材,進入全球市場
- 全名:ISO 13485 醫療器材品質管理系統標準 (ISO 13485 Medical devices Quality management systems standards )。
- 誰制定 ISO 13485 ? 國際標準組織(International Organization for Standardization)。
- 現行版本:2016 版本。
- 相關標準:ISO 13485 包含了一些醫療器材的專業要求,刪減了 ISO 9001不適於作爲法規要求的某些要求,例如 客戶滿意度專章要求。而ISO 13485是以 ISO 9001(2008) 為藍本,並因應醫療器材產業特性加以增、刪部分條文,成為一個可單獨使用的標準。但僅符合 ISO 13485 標準的公司,並不得宣稱其亦符合 ISO 9001 標準。
ISO 13485 關聯的規範常見的還有引述標準
1. ISO14971 : 2019
2. IEC 62366
3. IEC 62304
4.安全類的法規,常見列舉如下:
4.1 生物相容性
| 項次 | 標準 | 名稱 |
| 1 | F1980-16 |
醫療器械無菌屏障系統加速老化的標準指南 |
| 2 | ISO 10993-10:2010 |
醫療器材的生物學評估。Part10:刺激和皮膚過敏試驗 |
| 3 | ISO 10993-11:2006 |
醫療器材的生物學評估。Part11 :毒性試驗 |
| 4 | ISO 10993-12:2012 |
醫療器材的生物學評估。Part12:樣品製備和參考材料 |
| 5 | ISO 10993-1:2018 |
醫療器材的生物學評估。Part1 :風險管理過程中的評估和測試 |
| 6 | ISO 10993-5:2009 |
醫療器材的生物學評估。Part5:體外細胞毒性試驗 |
| 7 | ISO 10993-7:2008 / Cor 1:2009 |
醫療器材的生物學評估。Part7:環氧乙烷滅菌殘留物 |
4.2 滅菌規範
| 項次 | 標準 | 名稱 |
| 1 | ISO 11135:2014/CORR 2015,1,31 |
環氧乙烷滅菌 - 醫療器材滅菌過程的開發,驗證和常規控制要求日 |
| 2 | ISO 11137-1:2015 | 輻射滅菌 Part1:醫療器材滅菌過程的開發,驗證和常規管制制要求 |
| 3 | ISO 17665-1:2006 | 濕熱滅菌- Part1:醫療器材滅菌過程的開發,驗證和常規管制要求 |
5.醫療電器類常見規範:
5.1 IEC 60601 系列 (適用於醫電設備 )
5.2 IEC 61010 系列 (適用於體外診斷設備、實驗室設備 )
5.3 IEC 60529 (防塵防水試驗 )
5.4 IEC 60068 系列 (環境與可靠度試驗 )
5.5 特別說明:IEC 60601-1-2 (Ver 4)對有關醫療產品的要求作了重大更改,修改部分針對醫療器械安全測試、IEC 60601 測,以及與醫療器械基本電氣安全和基本性能相關的風險管理。而在 2018年12月3 日,IEC 60601-1-2已強制應用於向美國 FDA 提交的新產品以及進入歐盟的醫療產品。
ISO 13485 :2016 新版條文重點摘要
ISO 13485 與 ISO 9001
ISO 13485:2016 使用 ISO 9001:2008 為主體進行撰寫。ISO 13485:2016 共有8個章節,而 ISO 9001:2015 採用 Annex SL 架構撰寫,兩者呈現不一致的條文架構。有鑑於此,ISO 13485:2016 新版條文提供附件 Annex B,以供組織可以方便對照使用,在實務上更方便同時導入兩個系統。
強調生命週期及各國法規要求
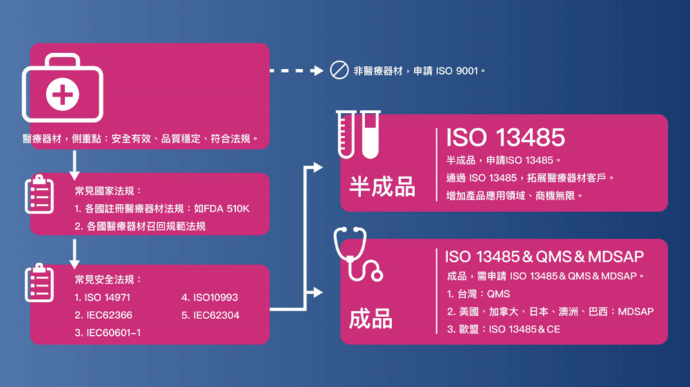
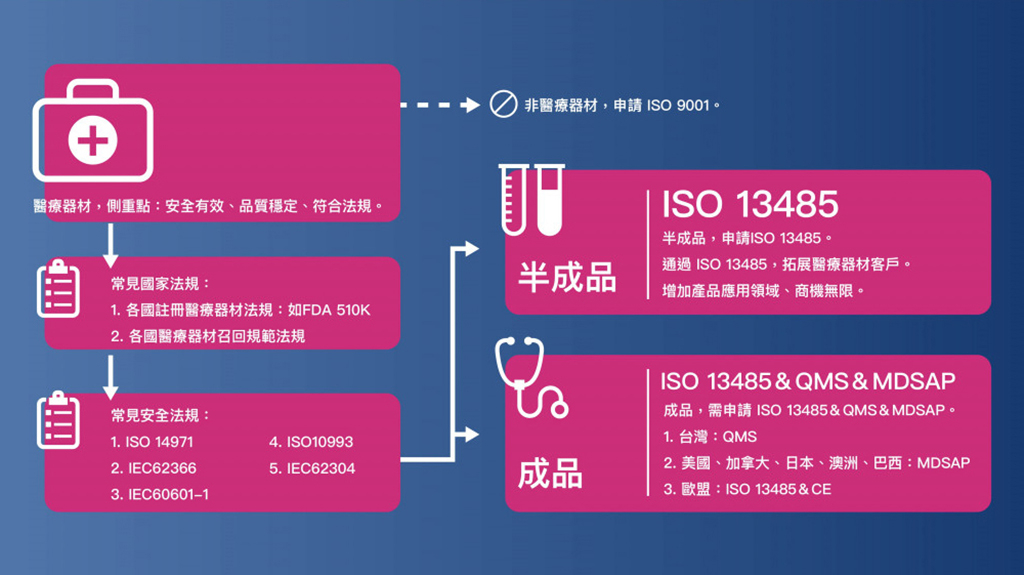
再者,ISO 13485:2016 更適用於整個醫療器材之供應鏈,並調和了各國的法規要求,2016年版的ISO13485要求驗證機構可能應進行不定期稽查。此外,ISO 13485:2016 也規定品質管制範圍擴展到產品整個生命週期(圖一)。
ISO 13485:2016 側重點有哪些
強調醫療器材安全性之說明,並輔以ISO9001:2008版對品質要求,以PDCA原則闡述品質保證之要求。再強調除品質外之產品安全之保證要求,以確保兼顧品質外,也須符合各項安全要求。
「安全有效」將是導入ISO13485一個很重要的概念。
ISO 13485:2016 改版有哪些重點
- 矯正預防措施,加入預實施之矯正行動是否引入新的風險或違反法規。
- 軟體確效 :在以往軟體確效是沒有要求但是在於新條文4.1.6他是需要進行的,只要是與產品品質有關的軟體使用,皆需要進行軟體確效,非以往的製程軟體才需要,在新條款7.6亦說明監督與測量之電腦軟體也需要進行確效。
- 教育訓練成效性評估的方式應依風險進行選擇。
- 外包/採購之變更管理協議簽訂
- 上市後行動(PMA)
- 產品生命週期管理(下圖一有對生命週期做較完整的敘述)
- EN ISO13485的附件(Annex Z)
- 與ISO9001:2015的協調性
- ISO13485:2016的主幹為ISO9001:2008,因此仍保留「管理代表」、「品質手冊」,但未來改版預計還是會朝向Annex SL的方向,讓所有管理系統可以都是HLS的架構
- 設計開發需要明確的驗證及確效計畫,包括:允收準則、抽樣大小
- 汙染管制:新版13485針對汙染控制新增在6.4.2條款,說明組織應文件化汙染管制方式,如:微生物管制或落塵管制。
- 值得注意的:新版ISO13485在條文7.1引述出ISO14971,不再標註發行年份,實務上,2018年ISO14971已發布DIS(草案版),預計2019年後釋出新版本。
取得 ISO 13485: 2016 證書有何益處?
符合外銷出口國的法令法規要求與客戶的期待,順利拓展外銷市場。國內的醫療器材製造業者一旦通過 ISO13485 認證,就等於拿到出口歐盟的通關門票,並有助於企業開拓國際市場。此外,為了更快打入國際市場,國內醫療器材製造業者建立品質管理系統時,已逐漸把 「ISO 9001:2015」+「ISO13485:2016」+「歐盟CE」三大認證一併申請。其他的效益包括:定期檢視並改善組織內的管理流程,進而提高效率、降低成本。提供明確的規範,監督供應商達到一致性的品質標準。證明您所生產的醫療器材產品或服務,是更安全、更有效。
若有其他國別銷售,MDSAP認證需求可能需要被評估。I
ISO 13485 :2016 新版條文章節
ISO 13485 :2016 條文章節架構,前3章節依序為 1.適用範圍、2.引用標準、3.名詞與定義,其餘章節詳列如下:
4.1 一般要求
4.2 文件化要求
4.2.1 概述
4.2.2 品質手冊
4.2.3 醫療器材文件
4.2.4 文件管制
4.2.5 紀錄管制
5.1 管理承諾
5.2 顧客為重
5.3 品質政策
5.4 規劃
5.4.1 品質目標
5.4.2 品質管理系統規劃
5.5 責任、職權及溝通
5.5.1 責任與職權
5.5.2 管理代表
5.5.3 內部溝通
5.6 管理審查
5.6.1 概述
5.6.2 審查輸入
5.6.3 審查輸出
6.1 資源提供
6.2 人力資源
6.3 基礎設施
6.4 工作環境與汙染控制
6.4.1 工作環境
6.4.2汙染控制
7.1 產品實現之規劃
7.2 顧客有關之過程
7.2.1 產品有關要求之決定
7.2.2 產品有關要求之審查
7.2.3 溝通
7.3 設計與開發
7.3.1概述
7.3.2設計與開發規劃
7.3.3 設計與開發輸入
7.3.4 設計與開發輸出
7.3.5 設計與開發審查
7.3.6 設計與開發驗證
7.3.7 設計與開發確效
7.3.8設計與開發移轉
7.3.9設計與開發變更之管制
7.3.10設計與開發檔案
7.4 採購
7.4.1 採購過程
7.4.2 採購資訊
7.4.3 所購產品之驗證
7.5 生產與服務供應
7.5.1 生產與服務供應之管制
7.5.2 清潔與滅菌管制
7.5.3 安裝活動
7.5.4 服務活動
7.5.5 無菌醫療器材之特別要求
7.5.6 生產與服務供應過程之確效
7.5.7 滅菌與無菌屏障過程確效之特別要求
7.5.8. 識別
7.5.9 追溯
7.5.10顧客財產
7.5.11 產品防護
7.6 監視與量測裝置之管制
8.1 概述
8.2 監視與量測
8.2.1 回饋
8.2.2抱怨處理
8.2.3回報監管機構
8.2.4 內部稽核
8.2.5 過程之監視與量測
8.2.6 產品之監視與量測
8.3 不符合產品之管制
8.3.1概述
8.3.2交付前不符合產品之措施
8.3.3交付後不符合產品之措施
8.3.4 重工
8.4 資料分析
8.5 改進
8.5.1概述
8.5.2 矯正措施
8.5.3 預防措施
圖解 ISO 13485 :2016 證書

▲圖解 ISO 13485 證書,驗證機構(Certification Body,CB)與認證機構(Accreditation Body,AB)。
領導力企管採用私人機構與政府單位的二分法協助您辨別,驗證機構(Certification Body,CB)是私人機構,包括 BSI、SGS、BV、TUV NORD、UL以及AFNOR。此外,國家認證機構(National Accreditation Body,AB)是政府機構,例如中華民國TAF、英國UKAS、美國 ANAB、法國 COFRA、中國 CNAB、日本 JAB、德國 DAR 及 韓國 KAB…等。
多年來,全球各國政府的認證機構共同成立國際認證論壇(International Accreditation Forum,IAF),彼此陸續簽署多國相互承讓協議,以減少第三方驗證機構必需向全球各國政府的認證單位重覆申請認證。換句話說,瑞士驗證機構(Certification Body,CB)SGS 所核發的 ISO 13485 證書,原先有效邊界只限於瑞士;一旦商務範圍離開了瑞士,這張證書就不被其它國家承認。然而,由於瑞士政府早已是IAF國際認證論壇成員,因此這張證書有效邊界已被全球IAF國際認證論壇成員國認可。IS
國內的有驗證機構可執行 ISO 13485 嗎?
國內可以執行 ISO13485 且有公信力的驗證機構不多,且實務上因應不同品項及申請需求可能有不同的驗證公司需求。若有認證需求,可以先與領導力企管聯繫,找到適合的驗證機構。透過初篩,可以更精準的找到驗證機構。
需注意,並不是每間驗證公司發的 ISO 13485 證書都有國際的公信力。
ISO 13485 申請前,我該注意什麼事?
產品是半成品或成品?
1.1如果是成品,需要確認是否被認定成醫療器材,醫療器材的定義在世界各國會有些許不同,要申請ISO13485。例如:市售的按摩器材在台灣不認定成醫療器材,但有些國家認定是醫療器材(如泰國。)
1.2 如是半成品,只要舉證是應用在醫療器材上,且有試產或量產紀錄,都符合可以申請 ISO 13485 條件。
確我們將要開發醫材品半成品應用領域,目前是否沒有訂單及客戶,有辦法申請?
因為測試項目及應用領域不明確,通常驗證公司無法接受委託,建議可以與領導力企管近一步討論可以進入醫材領域的方式。領導力企管成功協助多間科技電子從電子領域跨足醫療器材產業,提供您最佳解決方案。
不做臨床是否可以申請 ISO 13485?
要看法規,每個國家對醫療器材的臨床要求有可能不同。
可以只申請製造或是研發功能的 ISO 13485 嗎?
可以,但不管是擁有研發權責或是為代工廠都要舉證產品的安全性,通常這些安全性測試項目需要測試性能安全或臨床測試,不同醫療器材測定項目是不一樣的,至於要測定哪些項目,可以透過ISO14971風險評估方式鑑別或依照欲輸入國別法規要求。
計ISO13484:2016證書效益在美國、日本及加拿大適用嗎?
ISO 13485 效力不全然在美國等國家有效,MDSAP效力才有足夠效益。MDSAP 申請可見 MDSAP 報導。
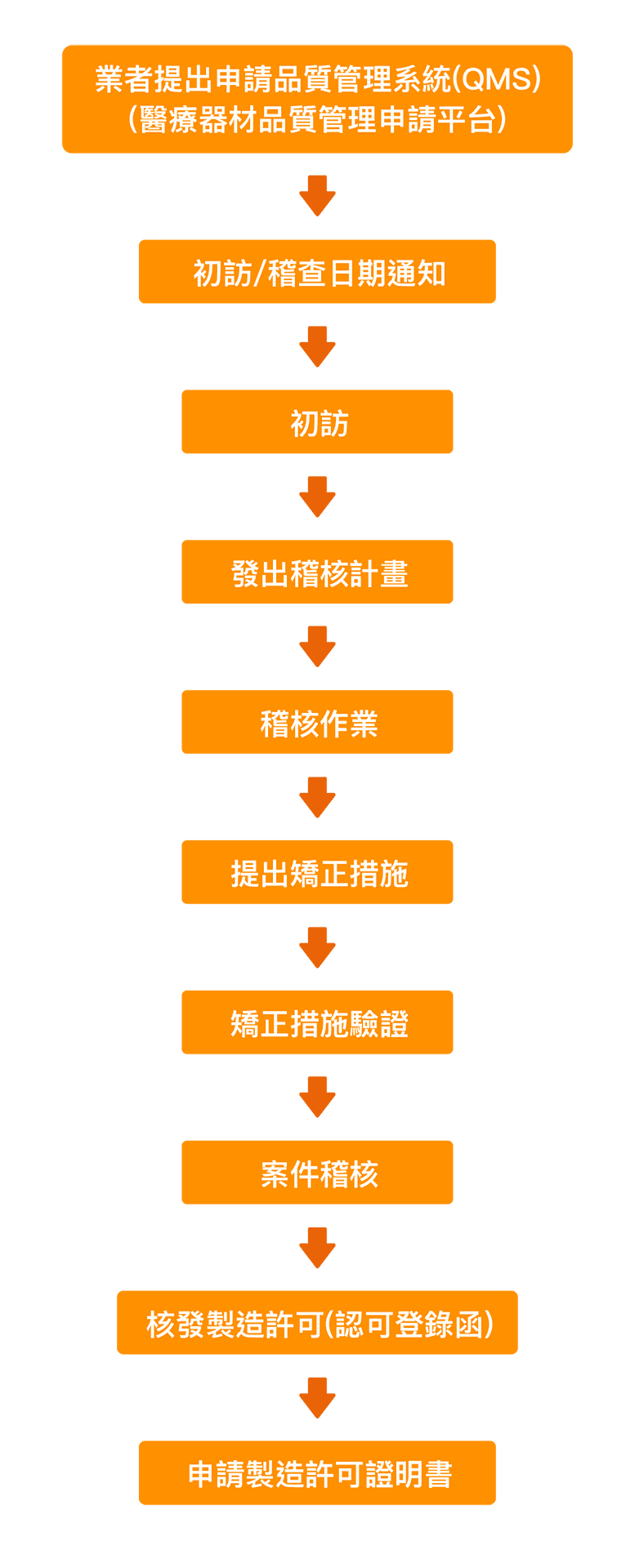
其他 Q&A – QMS 醫療器材品質管理系統準則(舊稱GMP)
如果你的銷售對象在台灣,也是國產的醫療器材製造廠,那麼,QMS是你需要申請的項目。
2.1 需具備工廠登記證,沒有廠登是不符合申請規範的。
2.2 備妥品質手冊遞交衛福部專責單位提出申請。
2.3 製造業醫療器材商許可執照。
2.4 必須是“醫療器材”且是“醫材成品”才可以或有需要申請,如是半成品,不需要且不能申請QMS。
是由衛福部主導,以查廠確保醫療器材製造業的品質管理受到政府的監管,類似 FDA CFR 820、加拿大的 CMDCAS 監管機制。不過 FDA/ CMDCAS 的查廠隨著 MDSAP 的發展已逐漸取消,但國內 GMP 機制仍被保留,查廠內容及機制類似ISO 13485。
經認可之醫療器材優良製造規範協施評鑑機構名單如下:
4.1. 財團法人工業技術研究院量測技術發展中心。
4.2. 財團法人台灣商品檢測驗證中心。
4.3. 財團法人塑膠工業技術發展中心。
4.4. 財團法人金屬工業研究發展中心。
a.業者基本資料
b.製造廠基本資料
c.申請品項及作業活動
d.主要管理階層
e.各項產品製造流程
f.主要原物料及零組件清單
g.主要生產製造設備清單
h.主要檢驗測試設備清單
i.全廠配置圖
j.醫療器材檔案清單
k.程序文件清單
l.申請的檢查模式
醫療器材系列客製化特色服務
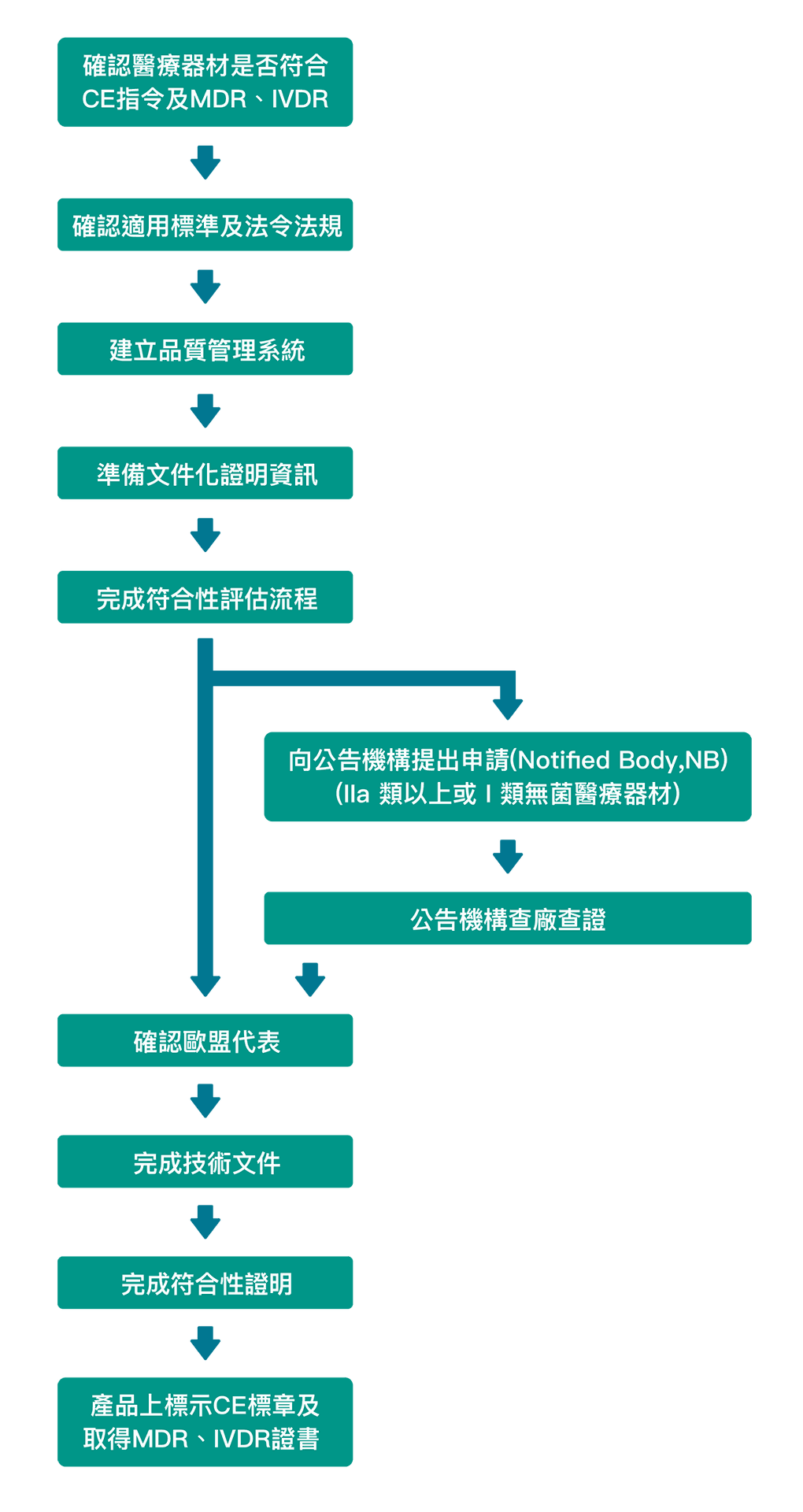
全球對於醫療器材的重視,除製造外,也包含進出口販售,領導力推出「醫療器材管理系統客製化服務」,除了最基礎的「ISO 13485:2016導入服務」亦針對醫療器材品質管理系統準則(QMS)進行調和,預計販售至歐盟也須具備的「醫療器材指令CE Marking」,銷往美國、加拿大、澳洲、巴西及日本等國家所被要求「MDSAP 醫療器材單一稽核方案」相關客製化服務,這些客製化的醫療器材管理系統,讓國內預計進軍全球的醫療廠商,有多元的搭配組合:
服務項目一:醫療器材管理系統群導入前評鑑
- ISO 13485:2016 模擬評鑑
- CE Marking 導入前模擬評鑑,確認文件完整程度
- MDSAP 導入前模擬評鑑,確認文件完整度
- 醫療器材建廠諮詢
服務項目二:醫療器材管理系統教育訓練
- ISO 13485:2016 條文教育訓練
- ISO 13485:2016 內部稽核人員教育訓練
- ISO14971:2007/ISO14971:2018(DIS) 風險認知教育訓練
- ISO14971:2007/ISO14971:2018(DIS) 風險評估報告引導
- ISO14971:2007/ISO14971:2018(DIS) 實務分享
服務項目三:醫療器材管理系統導入服務(整案輔導專案)
- 台灣衛服部 QMS 導入服務
- ISO 13485:2016 醫療器材全新導入服務
- ISO 13485:2016 既有文件優化引導輔導服務
- CE Marking 申請及導入服務
- MDSAP 法規諮詢服務
- MDSAP 系統導入服務
領導力企管的醫療器材產業成功案例


▲領導力企管於 2018年11月,至衛福部對審查專家進行 ISO 14971 教育訓練
領導力企管獲得台灣官方的肯定,受邀至衛福部所屬醫療器材審查單位 - 財團法人醫藥品查驗中心進行 ISO 14971醫療器材風險評估訓練課程,提升審查人員對醫療器材安全評估的專業技巧。
此外,領導力企管也成功輔導多間電子業轉型醫療器材製造業,如台郡科技(FPC)、富晶通科技(液晶螢幕)、宣德科技(RF天線)、台嘉碩科技(SAW)、音律電子(變壓器)等,經驗豐富,值得肯定。
以及國內的醫藥大廠跨足醫療器材,如得生製藥、立康生技;體外診斷試劑(IVD)產業的成功案例包含華聯生技、啟哲生醫、偉喬生醫等。
ISO 13485:2016 交給領導力企管
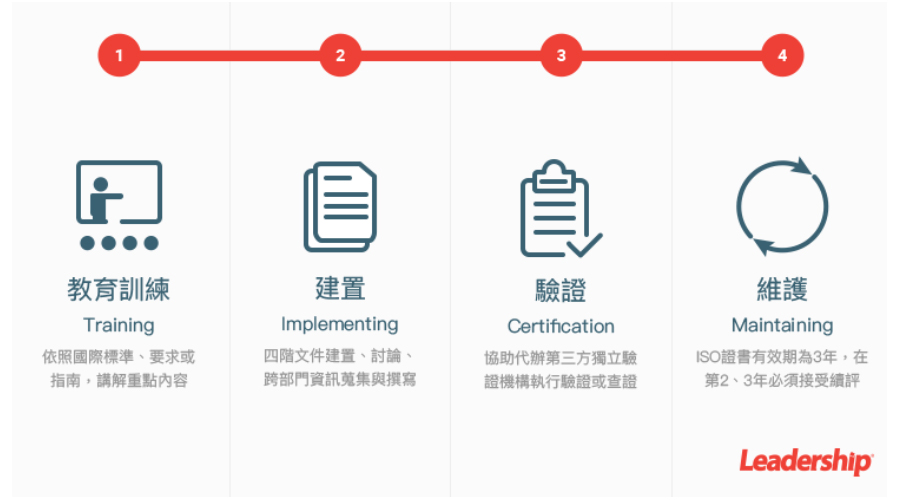
領導力企管提供 ISO 13485 :2016 最佳解決方案,我們將提供教育訓練(Training)、建置(Implementing)、 驗證(Certification)、維護(Maintaining)4大服務流程,協助建立 ISO 13485 :2016,最終產出符合規定的程序書、紀錄等相關文件,順利通過第三方驗證機構認證,取得符合國際公信力的 ISO 13485 :2016 證書。 歡迎立即與我們聯繫。